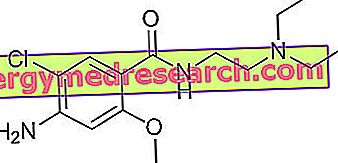
Τι είναι το Busilvex;
Το Busilvex είναι συμπύκνωμα για διάλυμα προς έγχυση (στάγδην σε φλέβα) που περιέχει τη δραστική ουσία βουσουλφάνη.
Για ποιους χρησιμοποιείται το Busilvex;
Το Busilvex ενδείκνυται στην προετοιμασία πριν από τη μεταμόσχευση αιματοποιητικών προγονικών κυττάρων (κύτταρα που παράγουν κύτταρα αίματος) σε ενήλικες και παιδιά. Αυτός ο τύπος μεταμόσχευσης πραγματοποιείται σε άτομα που υποφέρουν από μεταβολές αίματος (για παράδειγμα, σπάνια μορφή αναιμίας) ή καρκίνους αίματος, όπου είναι συνεπώς απαραίτητο να αντικατασταθούν αιματοποιητικά κύτταρα. Η θεραπεία με Busilvex ακολουθείται από θεραπεία με άλλο φάρμακο (κυκλοφωσφαμίδη στους ενήλικες και κυκλοφωσφαμίδη ή μελφαλάνη στα παιδιά).
Δεδομένου ότι ο αριθμός των ασθενών που υποβάλλονται σε αυτό το είδος κλιματισμού και μεταμόσχευσης είναι χαμηλός στην Ευρωπαϊκή Ένωση (ΕΕ), η βουσουλφάνη ονομαζόταν «ορφανό φάρμακο» (φάρμακο που χρησιμοποιείται σε σπάνιες ασθένειες) στις 29 Δεκεμβρίου 2000.
Το φάρμακο μπορεί να χορηγηθεί μόνο με ιατρική συνταγή.
Πώς χρησιμοποιείται το Busilvex;
Η χορήγηση του Busilvex θα πρέπει να γίνεται υπό την επίβλεψη του γιατρού που έχει εμπειρία στις προ-μεταμοσχεύσεις. Η συνιστώμενη δόση Busilvex σε ενήλικες είναι 0, 8 mg ανά κιλό σωματικού βάρους. Σε παιδιά και εφήβους (έως 17 ετών), η συνιστώμενη δοσολογία του Busilvex εξαρτάται από το σωματικό βάρος του ασθενούς και κυμαίνεται από 0, 8 έως 1, 2 mg / kg. Το Busilvex χορηγείται ως κεντρική ενδοφλέβια έγχυση (στάγδην σε κεντρική φλέβα στο στήθος). Κάθε έγχυση διαρκεί δύο ώρες και χορηγείται στον ασθενή κάθε έξι ώρες για τέσσερις διαδοχικές ημέρες πριν από τη θεραπεία με κυκλοφωσφαμίδη ή μελφαλάνη και μεταμόσχευση. Πριν από τη λήψη του Busilvex, οι ασθενείς θα πρέπει να υποβάλλονται σε προεπεξεργασία με αντισπασμωδικά φάρμακα (για την πρόληψη των επιληπτικών κρίσεων) και αντιεμετικά φάρμακα (για την πρόληψη του εμετού).
Πώς λειτουργεί το Busilvex;
Η δραστική ουσία του Busilvex, η βουσουλφάνη, ανήκει σε μια ομάδα φαρμάκων που ονομάζονται "αλκυλιωτικοί παράγοντες". Αυτές οι ουσίες είναι «κυτταροτοξικές», δηλαδή σκοτώνουν τα κύτταρα, ειδικά εκείνα που αναπτύσσονται γρήγορα, όπως τα καρκινικά κύτταρα ή τα προγονικά κύτταρα (ή τα «βλαστοκύτταρα») (δηλαδή τα κύτταρα που παράγουν άλλους τύπους κυττάρων). Η βουσουλφάνη χρησιμοποιείται πριν από τη μεταμόσχευση για την εξουδετέρωση των ανώμαλων κυττάρων και των αιματοποιητικών προγονικών κυττάρων στον ασθενή. Αυτή η διαδικασία ονομάζεται "μυελοποίηση". Η θεραπεία με κυκλοφωσφαμίδη ή μελφαλάνη στη συνέχεια χρησιμοποιείται για την καταστολή του ανοσοποιητικού συστήματος, έτσι ώστε να μειώνεται η φυσική άμυνα του σώματος. Αυτό προωθεί την «μεταμόσχευση» των μεταμοσχευμένων κυττάρων (δηλαδή, τα κύτταρα αρχίζουν να αναπτύσσονται και παράγουν φυσιολογικά κύτταρα αίματος).
Ποιες μελέτες εκπονήθηκαν για το Busilvex;
Οι επιδράσεις του Busilvex ελέγχθηκαν αρχικά σε πειραματικά μοντέλα προτού μελετηθούν σε ανθρώπους. Η φαρμακευτική εταιρεία παρουσίασε στοιχεία από πειραματικά μοντέλα που προέρχονται από την επιστημονική βιβλιογραφία.
Το Busilvex έχει μελετηθεί σε ασθενείς που πάσχουν κυρίως από καρκίνο του αίματος, οι οποίοι χρειάστηκαν μεταμόσχευση αιματοποιητικών προγονικών κυττάρων. Διεξήχθησαν δύο κύριες μελέτες, στις οποίες συμμετείχαν 103 ενήλικες, και μία μελέτη με 55 παιδιά. Η κύρια παράμετρος για την αποτελεσματικότητα βασίστηκε στον αριθμό των ασθενών με μυελοκαταστολή (π.χ. μειωμένος αριθμός λευκών αιμοσφαιρίων και αιμοπεταλίων) και "μοσχεύματα" (ο χρόνος που απαιτείται για την επιστροφή των λευκών αιμοσφαιρίων στα υψηλότερα επίπεδα).
Ποιο είναι το όφελος του Busilvex κατά τις μελέτες;
Η μυελοκαταστολή έχει παρατηρηθεί σε όλους τους ασθενείς, ενήλικες και παιδιά. Το μόσχευμα αποκτήθηκε κατά μέσον όρο μετά από δέκα ημέρες (σε ενήλικες) ή 11 ημέρες (σε παιδιά) σε περιπτώσεις «αυτόλογης μεταμόσχευσης» (δηλαδή μεταμόσχευση κυττάρων του ίδιου του ασθενούς, που συλλέχθηκαν και αποθηκεύθηκαν πριν από τη μεταμόσχευση). Το μόσχευμα επιτεύχθηκε μετά από 13 ημέρες (σε ενήλικες) και 21 ημέρες (σε παιδιά) σε "αλλογενή μεταμοσχεύματα" (μεταμόσχευση κυττάρων δότη).
Ποιοι κίνδυνοι σχετίζονται με το Busilvex;
Εκτός από τη μείωση του αριθμού των κυκλοφορούντων κυττάρων του αίματος, που είναι ο στόχος του φαρμάκου, λοίμωξη, διαταραχές του ήπατος, συμπεριλαμβανομένης της απόφραξης μιας ηπατικής φλέβας, ασθένεια μεταμόσχευσης ο ξενιστής (όταν τα μεταμοσχευμένα κύτταρα επιτίθενται στον οργανισμό του ασθενούς) και οι αναπνευστικές (πνευμονικές) διαταραχές. Ο πλήρης κατάλογος όλων των ανεπιθύμητων ενεργειών που αναφέρθηκαν με το Busilvex περιλαμβάνεται στο φύλλο οδηγιών χρήσης.
Το Busilvex δεν πρέπει να χορηγείται σε άτομα που ενδέχεται να παρουσιάσουν υπερευαισθησία (αλλεργία) στη βουσουλφάνη ή σε οποιοδήποτε άλλο συστατικό. Δεν πρέπει να χορηγείται σε έγκυες γυναίκες. Ο θηλασμός θα πρέπει να διακόπτεται κατά την έναρξη της θεραπείας με Busilvex. Το Busilvex μπορεί να βλάψει τη γονιμότητα και στα δύο φύλα. Επομένως, οι γυναίκες ασθενείς δεν πρέπει να μείνουν έγκυες κατά τη διάρκεια και έως έξι μήνες μετά τη θεραπεία και οι άνδρες ασθενείς δεν πρέπει να αναπαραχθούν κατά τη διάρκεια και έως έξι μήνες μετά τη θεραπεία με το φάρμακο.
Ιδιαίτερη προσοχή συνιστάται όταν χρησιμοποιούνται ταυτόχρονα φάρμακα όπως η ιτρακοναζόλη (που χρησιμοποιείται για ορισμένους τύπους λοιμώξεων), η τετοβεμιδόνη (χρησιμοποιείται για τη θεραπεία του πόνου) και η παρακεταμόλη. Για περισσότερες λεπτομέρειες, ανατρέξτε στο φύλλο οδηγιών χρήσης.
Για ποιους λόγους εγκρίθηκε το Busilvex;
Η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) κατέληξε στο συμπέρασμα ότι έχει αποδειχθεί η αποτελεσματικότητα του Busilvex και ότι αποτελεί εναλλακτική λύση έναντι των δισκίων βουσουλφάνης, τα οποία παρουσιάζουν μειονεκτήματα, συμπεριλαμβανομένου του μεγάλου αριθμού δισκίων που πρέπει να ληφθούν. Η CHMP αποφάσισε ότι τα οφέλη του Busilvex υπερτερούν των κινδύνων που συνδέονται με αυτό ως κλινική θεραπεία πριν από τη μεταμόσχευση αιματοποιητικών προγονικών κυττάρων. Συνεπώς, η επιτροπή συνέστησε να δοθεί άδεια κυκλοφορίας στο Busilvex.
Περισσότερες πληροφορίες για το Busilvex:
Στις 9 Ιουλίου 2003, η Ευρωπαϊκή Επιτροπή χορήγησε άδεια κυκλοφορίας σε ολόκληρη την ΕΕ στον Pierre Fabre Médicament για τη Busilvex. Η άδεια κυκλοφορίας ανανεώθηκε στις 9 Ιουλίου 2008.
Για να εγγραφείτε ως ορφανό φαρμακευτικό προϊόν Busilvex, κάντε κλικ εδώ .
Για το πλήρες EPAR του Busilvex, κάντε κλικ εδώ.
Τελευταία ενημέρωση της περίληψης: 07-2008.